我院黄辉教授团队发现血管钙化表观遗传学新机制
血管钙化导致血管壁变硬和弹性回缩受损、血流动力学不稳定、心脏后负荷增加,是心血管死亡的重要病变,迄今为止,其发病机制仍不清楚,缺乏有效治疗手段,是临床难题。
2021年7月15日,我院黄辉教授团队在Journal of Clinical Investigation发表了题为“ALKBH1-demethylated DNA N6-methyladenine modification triggers vascular calcification via osteogenic reprogramming in chronic kidney disease”的文章,阐明了ALKBH1介导的DNA 6mA去甲基化修饰血管钙化中的关键作用,为血管钙化的早期诊断和药物开发提供了新的潜在靶分子。
该研究以慢性肾脏病为研究模型,检测了伴有或不伴有主动脉弓钙化的患者的白细胞中6mA水平,发现白细胞中6mA水平随血管钙化严重程度的增加而显著降低;在血管钙化患者中,ALKBH1 mRNA和蛋白水平明显升高,而N6AMT1等表观遗传修饰酶表达无明显差异,表明主要是ALKBH1参与了钙化过程的6mA修饰调控,这些结果在慢性肾脏病小鼠模型中得以重复。同时,研究者利用敲低或过表达ALKBH1的腺相关病毒感染慢性肾脏病小鼠的动脉,发现敲低ALKBH1会抑制血管钙化,过表达ALKBH1会促进血管钙化。进一步发现小鼠原代VSMC在过表达ALKBH1时骨形态发生蛋白2(BMP2)降低,揭示了ALKBH1介导的成骨重编程和钙化依赖于 BMP2。机制上,ALKBH1去甲基化DNA 6mA修饰可以促进八聚体结合转录因子4(Oct4)与BMP2启动子结合并激活BMP2转录,BMP2通过增加骨形成的决定性转录因子RUNX2表达来促进VSMC成骨重编程和血管钙化,该分子机制进一步通过平滑肌特异性敲除Oct4所验证。
该临床研究建立了动态减少的DNA 6mA修饰与血管钙化进展之间的关联;机制结果证明了ALKBH1去甲基化DNA 6mA修饰在慢性肾病中的钙化影响。从临床角度来看,将来需要进一步研究DNA 6mA水平作为早期诊断方法和ALKBH1抑制作为预防血管钙化的潜在治疗策略。
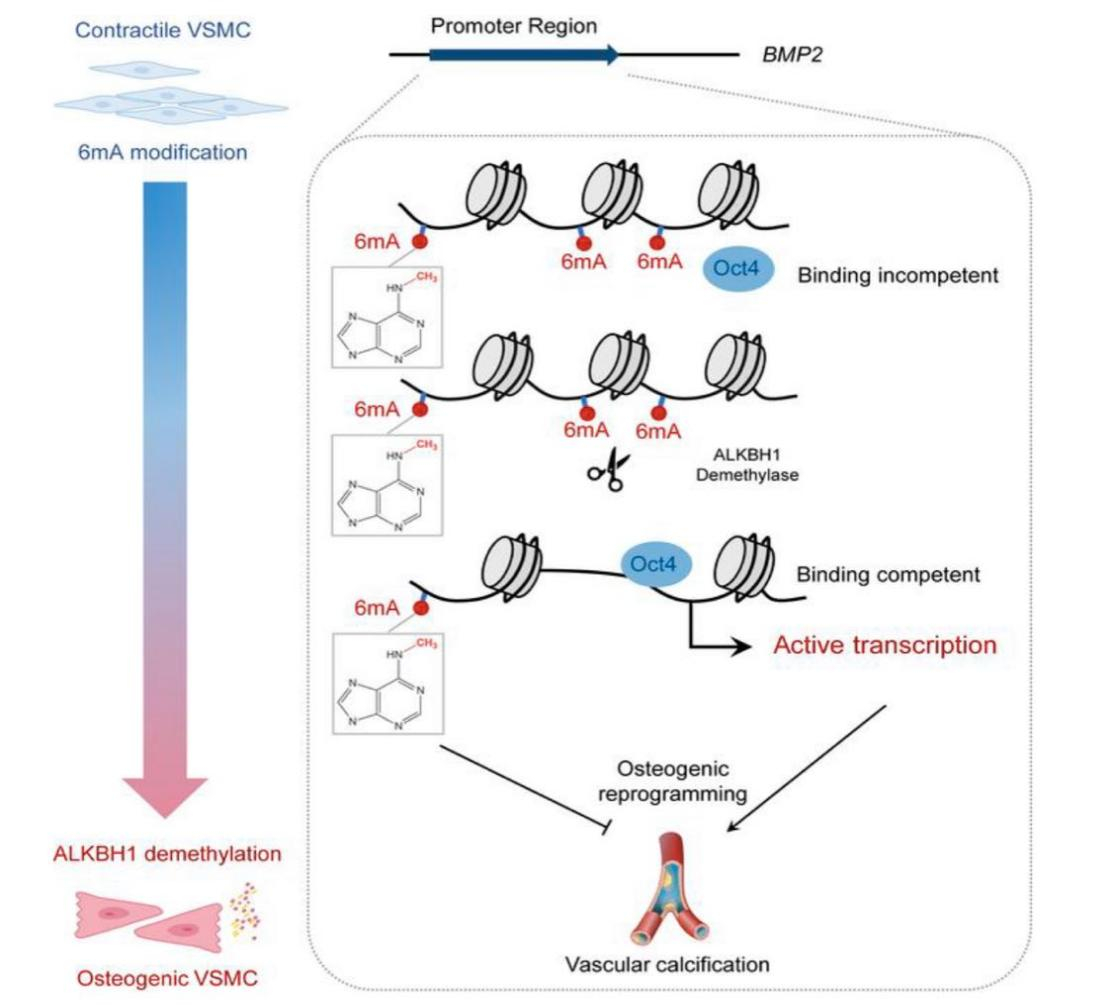
图1. ALKBH1介导的DNA 6mA去甲基化修饰促进血管钙化
该研究成果发表后得到业内广泛关注,其中Rush University医学院Jochen Reiser教授在同期杂志发表了题为“ALKBH1 reduces DNA N6-methyladenine to allow for vascular calcification in chronic kidney disease”高度评价,他们指出:“该研究为阐明血管钙化的分子机制提供了新的见解,也为其早期诊断提供了新的生物标志物”。
博士生欧阳柳(中山大学孙逸仙纪念医院),苏晓燕(东华医院),黎文信(中山大学附属第八医院),唐良秋(粤北医院),为本文的共同第一作者,黄辉教授为论文的独立通讯作者。
原文链接 :https://doi.org/10.1172/JCI146985
专题述评链接 :https://pubmed.ncbi.nlm.nih.gov/34263739/


